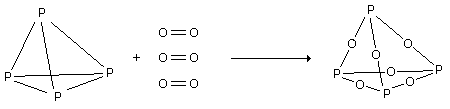| Calculs d'une chaleur de réaction | |||||||||||||||||
| Calcul d’une chaleur de réaction par la méthode des enthalpies de lien |
|||||||||||||||||
| Exemple :
Bilan thermique : Q1 + Q2 + Q3 + Q4 @ Q2 + Q3 + Q4 (cf ordres de grandeur)
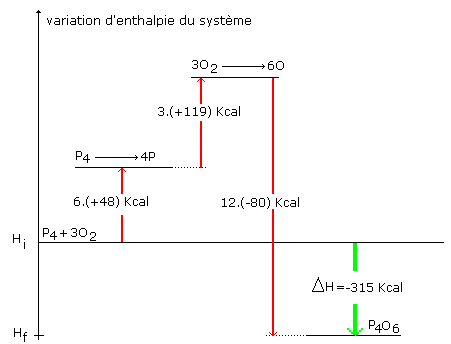
Calculons la variation d’enthalpie de la réaction de combustion du phosphore : DH = 6.(+48) + 3.(+119) + 12 .(-80) = - 315 Kcal diagramme enthalpique :
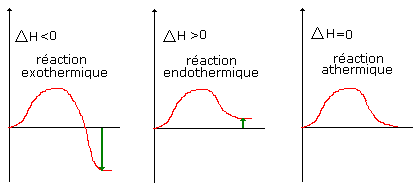
Il existe 3 sortes de diagrammes enthalpiques :
|
|||||||||||||||||
| Calcul d’une chaleur de réaction par la loi de Hess | |||||||||||||||||
Exemples : différent de
Soit le cycle :
H est une fonction d’état par conséquent : DH1 = DH + DH2 ou encore DH = DH1 – DH2 Donc pour la réaction CO + ½ O2 ---------->
CO2
D H = DHf(CO2) - DHf(CO) Loi de Hess : Pour une réaction chimique :
|
|||||||||||||||||
| Théorie du complexe activé | |||||||||||||||||
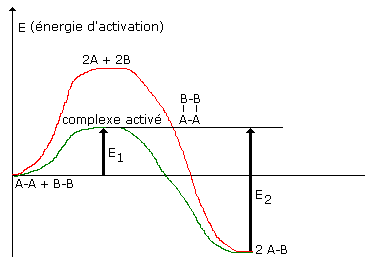
| En réalité dans une réaction chimique il n’y a pas cassure des
anciennes liaisons puis formation des nouvelles, mais formation d’une structure
intermédiaire
E1 est l’énergie d’activation dans le sens A-A + B-B ----------> 2 A-B Rien en effet ne s’oppose à ce qu’une réaction se fasse dans les 2 sens
puisque le complexe est le même.
|
|||||||||||||||||