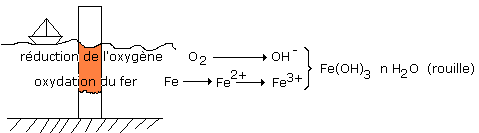|
On appelle corrosion , la destruction lente, progressive et
spontanée des métaux et de leurs alliages. Corrosion sèche : le métal
est attaqué par un gaz : Fe + Cl2 --------->
FeCl2
Corrosion humide : elle se produit en présence d’une solution.
Corrosion chimique
l’atmosphère contient des acides HNO3, H2SO4,
etc.., résidus de combustion.
Ces acides attaquent des métaux : Fe + 2 H+ --------->
Fe++ + H2
L’oxygène de l’air, en présence d’eau, oxyde le fer et forme Fe(OH)3,
nH2O : la rouille, cet oxyde est poreux et ne protège pas le fer.
L’acier inox contient du chrome : les oxydes qui se forment en surface de
l’alliage gênent la progression de l’oxygène.
Corrosion électrochimique
| -0,83 volt |
H2 + 2 OH- |
<---------> |
2 H2O + 2e |
0,83 volt |
| -0,44 volt |
Fe |
---------> |
Fe++ + 2e |
0,44 volt |
| 0,00 volt |
H2 |
<---------> |
2 H+ + 2e |
0,00 volt |
| 0,40 volt |
4 OH- |
<--------- |
O2 + 2 H2O + 4e |
-0,40 volt |
| 1,23 volt |
H2O |
<---------> |
½ O2 + 2 H+ + 2e |
-1,23 volt |
En milieu aqueux ou humide, il y a formation de micro piles à la surface du
métal :
|
- Ce phénomène se produit si
- un morceau de fer comporte à sa surface une impureté constituée par un métal
moins oxydable que lui.
- un morceau de fer est hétérogène dans sa structure.
- un morceau de fer plonge dans un milieu dont la teneur en oxygène
n’est pas constante :
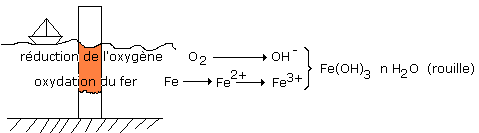
lutte contre la corrosion
protections par revêtements :
dépôt galvanique d’un métal plus oxydable (zinc sur fer)
peintures étanches, films plastiques, parkérisation, etc…
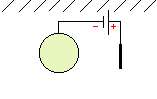
protections électrochimiques :
|
|
| relier la structure à protéger au pôle négatif
d’un générateur |
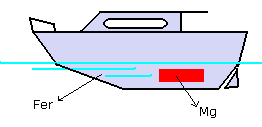
relier la structure à protéger à un métal plus oxydable
(anode sacrifiée) |
RETOUR
|